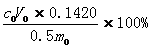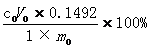一、 实验原理及方法
根据《中G药典》磷酸二氢钠含量测定:取本品约6.3g,精密称定,加新沸过的冷水100ml溶解后,照电位滴定法,用硫酸滴定液(0.5mol/L)滴定。每1ml硫酸滴定液(0.5mol/L)相当于142.0mg的磷酸氢二钠。
磷酸氢二钠含量:药典2010版二部1256页
二、 实验仪器及推荐配置
雷磁自动电位滴定仪
231-01 pH玻璃
电极 232饱和甘汞参比
电极
三、 实验试剂
1、滴定液:0.5mol/L硫酸溶液配制
取硫酸30ml,缓缓注入适量去离子水中,冷却**室温,移入1000ml容量瓶中,并用水稀释**刻度。
2、基准纯无水碳酸钠:在270-300℃干燥**恒重
3、样品
四、 样品分析及结果计算
1、标定
取在270-300℃干燥**恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解。在自动电位滴定仪上滴定**终点,每1ml硫酸滴定液(0.5mol/L)相当于53.00mg的无水碳酸钠。
按下列公式计算
CH2SO4=0.5(
mNa2CO3/0.053)/
V H2SO4
0.5 - 硫酸标准溶液理论浓度(mol/L)
C
H2SO4 – 硫酸标准溶液浓度(mol/L)
V
H2SO4 - 滴定**终点时消耗硫酸的体积(ml)
m
Na2CO3 - 称取的无水碳酸钠质量(g)
0. 053 - 与1.00ml硫酸标准溶液[c(H
2SO
4) 0.500mol/L]相当的无水碳酸钠的质量(g)
2、样品分析
取样品约6.3克,精密称定,加新沸过的冷水100ml溶解后,在雷磁自动电位滴定仪上,用硫酸滴定液(0.5mol/L)滴定。
按下列公式计算:
磷酸氢二钠含量=
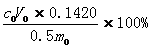
0.5 – 硫酸标准溶液理论当量浓度(mol/L)
 0
0 – 硫酸标准溶液实际标称浓度(mol/L)
V
0 - 滴定突跃点时消耗硫酸的体积(ml)
 0
0 - 样品质量(g)
0.1420 - 与1.00ml硫酸标准溶液[c(H
2SO
4)0.5mol/L]相当的磷酸氢二钠的质量(g)
五、 结果(谱图)
仪器准备,参照自动电位滴定仪说明书

六、 结论和建议
1、实验用硫酸标准溶液配制好后需标定浓度。
2、此化学反应突跃明显,需设置在“中”
三乙醇胺含量测定
一、 实验原理及方法
根据《中G药典》三乙醇胺含量测定: 取本品约1.2g,精密称定,置250ml锥形瓶中,加新沸的冷水75ml,照电位滴定法,用盐酸滴定液(1mol/L)滴定。每1ml盐酸滴定液(1mol/L)相当于149.2mg的三乙醇胺。
三乙醇胺含量测定:药典2010版二部1180页
二、 实验仪器及推荐配置
雷磁自动电位滴定仪
231-01型玻璃pH
电极 212-01型参比电极
三、 实验试剂
1、滴定液:1mol/L盐酸溶液配制
取90ml分析纯盐酸,溶解于去离子水中,移入1000ml容量瓶中,并用水稀释**刻度,摇匀。
2、基准纯无水碳酸钠:在270-300℃干燥**恒重
3、样品
四、 样品分析及结果计算
1、 标定
取在270-300℃干燥**恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解。在自动电位滴定仪上滴定**终点,每1ml盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠。
按下列公式计算
CHCl=1×(
mNa2CO3/0.053)/
VHCl
1 – 盐酸标准溶液理论浓度(mol/L)
C
HCl - 盐酸标准溶液浓度(mol/L)
V
HCl - 滴定**终点时消耗盐酸的体积(ml)
m
Na2CO3 - 称取的无水碳酸钠质量(g)
0. 053 - 与1.00ml盐酸标准溶液[c(HCl) 1.000mol/L]相当的无水碳酸钠的质量(g)
2、样品分析
取样品约1.2g,精密称定,置250ml锥形瓶中,加新沸的冷水75ml,摇匀,在雷磁自动电位滴定仪上,用盐酸滴定液(1mol/L)滴定。
按下列公式计算
三乙醇胺含量=
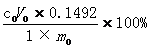
1 – 盐酸标准溶液理论当量浓度(mol/L)
 0
0 - 盐酸标准溶液实际标称浓度(mol/L)
V
0 - 滴定突跃点时消耗盐酸的体积(ml)
 0
0 - 样品质量(g)
0.1492 - 与1.00ml盐酸标准溶液[c(HCl)1.000mol/L]相当的三乙醇胺的质量(g)
五、 结果(谱图)
1、 仪器准备,参照自动电位滴定仪说明书
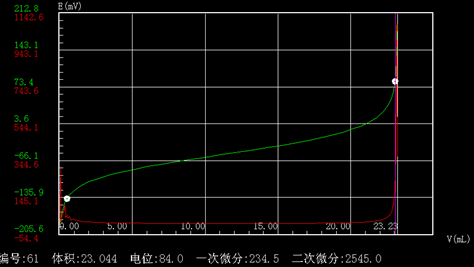
六、 结论和建议
此化学反应突跃明显,设置在“中”mV量在100~150mV之间。#p#分页标题#e#